国民衛生の動向でみる薬剤師国家試験の薬事制度問題まとめ
「国民衛生の動向」は公衆衛生、保健・福祉、医療提供体制、薬事などの最新の動向を解説し、医療従事者や国家試験対策として広く用いられています。
薬剤師国家試験では、医薬品医療機器等法などの薬剤師業務に関わる法律、多様な医薬品の安全性を確保するための制度など、様々な法規に関する知識が問われます。
このページでは、過去の第109回(2024年)から第98回(2013年)までの12年分の薬剤師国家試験の中から、薬事に関わる制度ごとに、「国民衛生の動向」の記述を基に要点を簡潔にまとめ、理解と実践を図れるように構成しています。
出題傾向を把握し、より詳細な制度内容や関連規定、歴史的背景や改正点などを「国民衛生の動向」内で確認し、薬事制度に対する理解を深めていただければ幸いです。
 |
厚生の指標増刊
発売日:2025.8.26 定価:3,740円(税込) 416頁・B5判 雑誌コード:03854-08
ご注文は書店、または下記ネット書店、電子書籍をご利用下さい。 |
ネット書店
電子書籍
目次
●第6編1章 薬事行政の動向
●第6編2章 医薬品等の安全性と有効性の確保
●第6編3章 特殊な医薬品、毒物・劇物
医療品、医療機器等の品質、有効性及び安全性の確保等に関する法律(医薬品医療機器等法、薬機法)
6編1章:薬事行政の動向
日本薬局方
- 日本薬局方は、医薬品の性状及び品質の適正を図るため、厚生労働大臣が薬事・食品衛生審議会の意見を聴いて定めた医薬品の規格基準書で、医薬品医療機器等法ではここに収められている物を医薬品と定義している。
- 厚生労働大臣は少なくとも10年ごとに全面にわたって見直しを行うよう、その改定について薬事・食品衛生審議会に諮問しなければならない。
▶109回必須(法規)75
医薬品医療機器等法第41条第1項において、日本薬局方を定め公示する目的を規定している条文の【 】に当てはまるのはどれか。1つ選べ。
「厚生労働大臣は、【 】を図るため、薬事・食品衛生審議会の意見を聴いて、日本薬局方を定め、これを公示する。」
- 医薬品の性状及び品質の適正
- 医薬品の安定供給の確保
- 医薬品の有効性及び安全性の確保
- 医療の安全確保
- 良質かつ適切な医療の確保
▶106回一般理論(法規)148
日本薬局方に関する記述のうち、誤っているのはどれか。1つ選べ。
- 厚生労働大臣が薬事・食品衛生審議会の意見を聴いて定めた医薬品の規格基準書である。
- 通則、生薬総則、製剤総則、一般試験法及び医薬品各条から構成される。
- 「日本薬局方に収められている物」は、医薬品医療機器等法において医薬品と定義されている。
- 薬局方は我が国独特の規格基準書であり、米国や欧州に同様のものは存在しない。
- 少なくとも10年ごとに全面にわたって見直されなければならない。
医薬品の分類
- 医薬品は、医師等によって使用またはその処方箋や指示により使用される医療用医薬品と、それ以外の一般用医薬品、一般用医薬品に移行するまでの要指導医薬品に分けられる。
- 一般用医薬品は、リスクの大きさに応じて第1類から第3類までの3つの区分に分類される。その販売に従事する者は、第1類医薬品については薬剤師が、第2類・第3類医薬品については薬剤師または登録販売者が販売または授与しなければならない。
▶103回必須(法規)73
薬局において、登録販売者が販売できるのはどれか。1つ選べ。
- 薬局製造販売医薬品
- 要指導医薬品
- 第一類医薬品
- 指定第二類医薬品
- 処方箋医薬品
医薬品販売業
薬剤師が販売または授与の目的で調剤の業務を行う場所で、営業時間中は薬剤師が常駐し、医療用医薬品の調剤のほか、一般用医薬品、要指導医薬品を販売することができる。
●店舗販売業
一般用医薬品と要指導医薬品以外の医薬品は販売できない。
●配置販売業
一般用医薬品以外の医薬品は販売できない。
●卸売販売業
薬局開設者等に対してのみ医薬品を販売する。
▶101回必須(法規)72
専ら薬局開設者等に医薬品を販売するのはどれか。1つ選べ。
- 店舗販売業
- 配置販売業
- 卸売販売業
- 医薬品製造業
- 医薬品製造販売業
▶104回必須(法規)72
店舗販売業において販売できないのはどれか。1つ選べ。
- 要指導医薬品
- 第一類医薬品
- 第二類医薬品
- 第三類医薬品
- 処方箋医薬品
要指導医薬品
- 要指導医薬品とは、承認に際して製造販売後に安全性に関する調査を実施することとされた品目や毒薬、劇薬のうち、厚生労働大臣が薬事・食品衛生審議会の意見を聴いた上で指定するものである。
- 要指導医薬品は、薬剤師が使用者本人に対面で情報提供・指導した上で販売することとされており、あらかじめ、要指導医薬品を使用しようとする者の年齢や他の薬剤等の使用の状況などを確認しなければならない。
- 要指導医薬品は一定の安全性評価期間終了後、安全性が確認されれば一般用医薬品に移行し、インターネット等での販売が可能となる。
▶108回必須(実務)89
一般消費者に対する要指導医薬品の日常の販売について、正しいのはどれか。1つ選べ。
- インターネットで販売できる。
- 配置による方法で販売できる。
- 使用する者の年齢を確認しなければならない。
- 使用する者が同居家族の場合も販売できる。
- 情報提供は薬剤師又は登録販売者が行う。
スイッチOTC
- 薬局やドラッグストアで購入できる薬をOTC(over the counter)医薬品という。
- 医療用医薬品のうち副作用が少なく安全性が高い薬としてOTC医薬品に転用したものをスイッチOTC医薬品という。
▶102回必須(実務)85・99回必須(実務)83類問
医療用医薬品としてすでに使われている有効成分が転用された要指導医薬品及び一般用医薬品を何というか。1つ選べ。
- 指定薬物
- ジェネリック医薬品
- オーファンドラッグ
- スイッチOTC
- ダイレクトOTC
医薬分業
- 医薬分業とは、医師が患者に交付した処方箋に基づき、薬剤師が調剤を行い、医師と薬剤師がそれぞれの専門分野で業務を分担することによって、医療の質の向上を図ることを目指すものである。
- 昭和30年(1955年)の法改正により医師等の処方箋発行が原則となった後、昭和49年(1974年)の診療報酬改定により処方箋料が大幅に引き上げられたことを契機に、急速に普及した。
▶105回一般理論(法規)144
医薬分業に関する記述のうち、適切なのはどれか。2つ選べ。
- 薬剤師法の施行を契機に、急速に普及した。
- 処方箋受取率は、都道府県の間でほとんど差がない。
- 処方箋を患者に交付する医師が、調剤を受ける薬局を指定することが望ましい。
- 複数の医療機関を受診しても、患者が特定の薬局を利用することで、薬剤服用歴を薬局で一元的に管理できる。
- 交付された処方箋により、患者自身が服用している薬の名称について知ることができる。
▶104回必須(法規)77
地域における薬局の役割に該当しないのはどれか。1つ選べ。
- 在宅医療への参画
- 地域住民の健康診断
- 医薬品の販売・調剤
- 生活習慣病等の健康相談応需
- 薬物乱用防止活動
健康サポート薬局
平成28年(2016年)から、かかりつけ薬剤師・薬局の基本的機能を備えた上で、積極的に地域住民の健康の維持・増進を支援する健康サポート薬局の公表制度が始まった。その届出要件として以下のような事項が挙げられる。
- 服薬情報の一元的な把握とそれに基づく薬学的管理・指導
- 休日を含む24時間対応、在宅対応
- 医療機関への受診勧奨やその他の関係機関への紹介
- 個人情報に配慮した相談スペースの確保
- 健康の維持・増進に関する相談対応と記録の作成
▶106回必須(法規)80
法令で以下のとおり定義されているのはどれか。1つ選べ。
「患者が継続して利用するために必要な機能及び個人の主体的な健康の保持増進への取組を積極的に支援する機能を有する薬局」
- 保険薬局
- 薬剤師会会営薬局
- 健康サポート薬局
- 地域包括支援センター
- ドラッグストア
▶105回必須(実務)87
健康サポート薬局の活動・業務内容として適切でないのはどれか。1つ選べ。
- アドヒアランスの悪い患者に対して、残薬を入れる袋を渡した上で来局してもらい、服薬状況を確認した。
- 健康相談で来局した地域住民の家庭血圧が高いことを確認したため、降圧剤を調剤した。
- 市販の医薬品を使用しても体調の改善が見られなかった地域住民に対して受診勧奨した。
- 地域住民に対して、医薬品の適正使用に関する講演を行った。
- 地域住民から介護サービスに関する相談があったため、地域包括支援センターを紹介した。
▶109回必須(実務)84
健康サポート薬局の届出要件の一つとして、適切なのはどれか。1つ選べ。
- 個人情報に配慮した相談窓口の設置
- 休日を除く24時間の開局
- 薬局内での無菌調剤
- 予防接種のためのワクチン調製
- 専門薬剤師による抗がん剤の選択支援
地域連携薬局・専門医療機関関連連携薬局
入退院時の医療機関等との情報連携や、在宅医療等に地域の薬局と連携しながら一元的・継続的に対応できる薬局。
●専門医療機関関連連携薬局
がん等の専門的な薬学管理に関係機関と連携して対応できる薬局。
▶109回必須(法規)76
次の文章の【 】に当てはまるのはどれか。1つ選べ。
他の医療提供施設と連携し、地域における医薬品の適正使用の推進、情報提供や指導を行うなどの機能を有する薬局として、都道府県知事の認定を受けて称することができる名称は、「【 】連携薬局」である。
- 医療
- 地域
- 多職種
- 医療機関
- 医療介護
医薬品等の製造販売業の許可
- 製造販売するものの区分ごとに、①第一種医薬品(処方箋医薬品)製造販売業、②第二種医薬品(処方箋医薬品以外の医薬品)製造販売業、③医薬部外品製造販売業、④化粧品製造販売業の許可が与えられ、それぞれ許可を受けた者でなければ製造販売してはならない。
- 製造販売業者には品質管理の基準(GQP)と製造販売後安全管理基準(GVP)の適合が許可要件とされる。
▶108回必須(法規)74
製造販売業者が対応すべき医薬品等の品質管理の基準を定めた省令はどれか。1つ選べ。
- GCP
- GLP
- GMP
- GQP
- GVP
▶98回必須(法規)72
医薬品製造販売業の許可を得るために適合する必要がある基準はどれか。1つ選べ。
- GCP(Good Clinical Practice)
- GLP(Good Laboratory Practice)
- GVP(Good Vigilance Practice)
- GMP(Good Manufacturing Practice)
- GPSP(Good Post-marketing Study Practice)
▶103回必須(法規)74
医薬品等に係るGVPは何の基準か。1つ選べ。
- 安全性に関する非臨床試験の実施
- 臨床試験の実施
- 製造管理及び品質管理
- 製造販売後の調査及び試験の実施
- 製造販売後安全管理
医薬品等の製造業の許可
- 製造業の許可は、製造の区分(医薬品、医薬部外品、化粧品)に応じて製造所ごとに与えられ、それぞれ許可を受けた者でなければ製造販売してはならない。
- 申請後、厚生労働省は製造所が厚生労働省令で定める基準に適合するかどうかについての書面による調査または実地の調査を行い、適合しないときは許可を与えないことができる。
▶101回一般理論(法規)142
医薬品の製造販売業及び製造業に関する記述のうち、正しいのはどれか。1つ選べ。
- 製造業の許可は、品目ごとに受けなければならない。
- 製造業の許可には、第1種と第2種の区分がある。
- 製造業の許可については、GQPが許可要件である。
- 製造販売業者が、医薬品を自社工場で製造する場合には、製造業の許可が必要である。
- 製造販売業者が、自ら輸入した医薬品を薬局開設者に販売する場合には、医薬品販売業の許可が必要である。
▶106回一般理論(法規)146
医薬品の製造販売業及び製造業に関する記述のうち、正しいのはどれか。2つ選べ。
- 第一種医薬品製造販売業の許可を受ければ、処方箋医薬品の製造販売を行うことができる。
- 製造販売業者が自社製品を製造する自社の製造所は、製造業の許可を受けているものとみなされる。
- 製造販売業者が、自ら輸入した医薬品を薬局開設者に販売する場合には、医薬品販売業の許可を必要としない。
- 製造業者が、自ら製造した医薬品を店舗販売業者に販売する場合には、医薬品販売業の許可を必要としない。
- 製造業者は、製造しようとする医薬品の品目ごとに許可を受けなければならない。
▶108回一般理論(法規)146
医薬品の製造販売業及び製造業に関する記述のうち、正しいのはどれか。2つ選べ。
- 製造業の許可は、製造所ごとに受けなければならない。
- 製造業者は、製造所ごとに医薬品総括製造販売責任者を設置しなければならない。
- 製造販売業者が、自ら輸入した一般用医薬品を店舗販売業者に販売する場合は、医薬品販売業の許可を必要としない。
- 製造販売業者が、医薬品を自社工場で製造する場合は、製造業の許可を受けたものとみなされる。
- 第1種医薬品製造販売業の許可を受けた場合は、第2種医薬品製造販売業対象の医薬品も製造販売することができる。
製造販売の承認・製造販売業の許可が必要な医薬品等
- 医薬品(日本薬局方に収められているもので承認を要しないものとして指定されたものを除く)
- 医薬部外品(承認不要医薬部外品基準に収められているものを除く)
- 名称の表示を省略しようとする成分を配合しようとする化粧品
これら以外の医薬品等については製造販売の承認を要しない。
▶100回一般(法規)141
医薬品の製造又は製造販売に関する記述のうち、正しいのはどれか。2つ選べ。
- 製造業の許可は、製造しようとする医薬品の品目ごとに受けなければならない。
- 業として医薬品の小分けを行おうとする者は、製造業の許可を受けなければならない。
- 製造業の許可の申請を行った場合、許可基準への適合の有無についての調査が行われる。
- 第一種医薬品製造販売業の許可を受ければ、すべての医療用医薬品を製造販売することができる。
- 日本薬局方に収載されている医薬品は、承認審査を受けずに製造販売することができる。
緊急承認・特例承認
▶102回一般理論(法規)143
医薬品の製造販売の承認に関して、誤っているのはどれか。1つ選べ。
- 承認を受けずに製造販売できる医薬品がある。
- 医療上特にその必要性が高いと認められる場合、承認審査が優先して行われる。
- 原薬等登録原簿に収められている原薬等を原材料とする場合は、登録されていることを証する書面をもって承認申請の資料の一部にすることができる。
- 国民の生命及び健康に重大な影響を与えるおそれがある疾病のまん延などを防止するために緊急に必要な医薬品の場合は、特例的に承認される制度がある。
- 製造販売業者は、承認事項の一部を変更しようとする場合、厚生労働省令で定める軽微な変更であれば、その内容を記録して保存することでそれを行うことができる。
医薬品等の製造販売の承認を与えない場合
- 申請者が、申請に係る医薬品に関する製造販売業の許可を受けていない場合
- 申請に係る医薬品を製造する製造所が製造業の許可等を受けていない場合
- 申請された効能または効果を有すると認められない場合
- 効能または効果に比べて著しく有害な作用を有することにより、使用価値がないと認められる場合
- 性状または品質が保健衛生上著しく不適当な場合
- 化粧品に含有されている成分が名称の記載を省略しようとする成分として不適切な場合
▶105回一般理論(法規)147
医薬品の製造販売の承認拒否事由として、適切でないのはどれか。1つ選べ。
- 申請に係る医薬品が、その申請に係る効能、効果を有すると認められないとき。
- 申請に係る医薬品が、その効能、効果に比して著しく高価格であるとき。
- 申請に係る医薬品が、その効能、効果に比して著しく有害な作用を有することにより、医薬品としての使用価値がないと認められるとき。
- 申請に係る医薬品の性状又は品質が、保健衛生上著しく不適当なとき。
- 申請者が、申請に係る医薬品に関する製造販売業の許可を受けていないとき。
▶108回一般理論(法規)143
医薬品の製造販売の承認拒否事由に該当するのはどれか。2つ選べ。ただし、特例承認や緊急承認などの特別な事例は除く。
- 申請者である企業が製造販売業の許可を受けていないとき。
- 申請に係る医薬品と同じ作用機序のものが、すでに10剤以上承認されているとき。
- 申請に係る医薬品が効能又は効果を有すると認められないとき。
- 申請に係る医薬品が海外での承認や審査を受けていないとき。
- 申請に係る医薬品の製造所における製造管理又は品質管理の方法が、「医薬品の臨床試験の実施に関する基準」に適合していると認められないとき。
医薬品等の承認審査に係る基準
製造管理及び品質管理の方法の基準
●GLP(Good Laboratory Practice)
非臨床試験の実施の基準
●GCP(Good Clinical Practice)
臨床試験の実施の基準
▶104回必須(法規)78・101回必須(法規)79類問
医薬品のGLPの説明として正しいのはどれか。1つ選べ。
- 医薬品の製造管理及び品質管理の基準
- 医薬品の臨床試験の実施の基準
- 医薬品の安全性に関する非臨床試験の実施の基準
- 医薬品の製造販売後安全管理の基準
- 医薬品の適正な流通管理の基準
医療機器
- 医療機器とは、人の疾病の診断や治療、予防に使用されること、または人の身体の構造や機能に影響を及ぼすことが目的とされている機械器具、歯科材料、医療用品、衛生用品、プログラム(再生医療等製品を除く)をいう。
- 医療機器のうち、副作用または機能の障害が生じた場合に人の生命および健康に重大な影響を与えるおそれがあるものを高度管理医療機器、人の生命および健康に影響を与えるおそれがあるものを管理医療機器、人の生命及び健康に影響を与えるおそれがほとんどないものを一般医療機器という。
▶107回一般理論(法規)145
次の分類のうち、コンタクトレンズが該当するのはどれか。1つ選べ。
- 高度管理医療機器
- 管理医療機器
- 一般医療機器
- 再生医療等製品
- 医薬部外品
▶102回一般理論(法規)141
医薬品医療機器等法に規定される医療機器に関する記述のうち、正しいのはどれか。2つ選べ。
- 人の疾病の診断、治療又は予防に使用されることを目的としたプログラムも医療機器に該当することがある。
- 人体に対するリスクの大きさによって、「高度管理医療機器」、「管理医療機器」、「一般医療機器」に分類される。
- 添付文書の記載事項は法令で定められていない。
- 再生医療等製品も医療機器に含まれる。
- 高度管理医療機器の販売においては、薬剤師による対面での情報提供が義務づけられている。
再生医療等製品の製造販売の承認
- 再生医療等製品とは、失った組織や臓器を再生させる治療として、人または動物の細胞に培養等の加工をしたもの、導入されて体内で発現する遺伝子を含有させたものをいう。
- 再生医療等製品の製造販売をしようとする者は、品目ごとに厚生労働大臣の承認を受けなければならない。再生医療等製品の性質から、有効性が推定され、安全性が確認できれば、条件と期限を付して承認し、承認後に有効性と安全を改めて検証する条件及び期限付承認の制度が設けられている。
▶105回必須(法規)75
法律において、条件及び期限付き承認の仕組みが規定されているのはどれか。1つ選べ。
- 医薬品
- 医療機器
- 医薬部外品
- 再生医療等製品
- 化粧品
希少疾病用医薬品
- 希少疾病用医薬品とは、対象患者数が本邦において5万人未満であること、用途に関して特に優れた使用価値を有することとなるなどの条件に合致するものとして、薬事・食品衛生審議会の意見を聴いて厚生労働大臣が指定し、公示されるものである。
- 希少疾病用医薬品の条件に該当しなくなった場合や、正当な理由なく試験研究または製造販売が行われない場合、厚生労働大臣は指定を取り消すことができる。
▶99回必須(法規)71
希少疾病用医薬品の指定の条件において、我が国におけるその用途に係る対象者数として規定されているのはどれか。1つ選べ。
- 5,000人未満
- 10,000人未満
- 50,000人未満
- 100,000人未満
- 200,000人未満
希少疾病用医薬品に係る規定
- 医薬品等の製造販売の承認に当たり、臨床試験の試験成績に関する資料の一部の添付を要しないこと、必要な審査または調査を他の医薬品に優先して行うことができる。
- 国は、希少疾病用医薬品の試験研究を促進するのに必要な資金の確保に努めること、税制上の措置を講ずることとしている。
▶100回一般(法規)143
希少疾病用医薬品として指定されたものに対して、国又は厚生労働大臣がとる施策として医薬品医療機器等法に規定されていないのはどれか。1つ選べ。
- 製造販売承認の申請にかかる審査について、他のものに優先して行うことができる。
- 試験研究を促進するために必要な資金の確保に努める。
- 試験研究を促進するために必要な税制上の措置を講ずる。
- 製造所における製造管理又は品質管理の方法が基準に適合しているかの調査について、他のものに優先して行うことができる。
- 再評価制度の対象から除外する。
▶105回必須(法規)80
希少疾病用医薬品に関する記述のうち、適切なのはどれか。1つ選べ。
- 指定難病の患者に対する治療薬のことである。
- 国が主体となって製品化を行う。
- 指定された後に、取り消されることはない。
- 承認されるまで、指定されたことは公開されない。
- 他の医薬品に優先して承認審査を受けられる。
▶104回一般理論(法規)143
希少疾病用医薬品に関する記述のうち、誤っているのはどれか。1つ選べ。
- 用途に係る対象者の数が、本邦において定められた人数に達しない場合に指定されるものである。
- 用途に関し、特に優れた使用価値があるものである。
- 指定について緊急を要する場合は、薬事・食品衛生審議会の意見を聴くことなく指定できる。
- 指定されたときは、その旨が公示される。
- 正当な理由なく試験研究が行われないときは、指定を取り消されることがある。
特定用途医薬品
▶109回一般理論(法規)144
特定用途医薬品の指定に必須となる要件はどれか。2つ選べ。
- 製造販売の承認が与えられた場合に、その用途に関し、特に優れた使用価値を有すること。
- その用途に係る対象者が我が国で5万人未満であること。
- その用途に関し、既に製造販売承認を与えられている医薬品と作用機序が明らかに異なる物であること。
- その用途が、感染症の拡大などの緊急時に用いる必要がある物であること。
- その用途が、厚生労働大臣が指定する区分に属する疾病の治療等であって、その用途に係る需要が著しく充足されていないと認められる物であること。
指定薬物
- 指定薬物とは、中枢神経系の興奮、抑制、幻覚の作用を有する蓋然性が高く、保健衛生上の危害が発生するおそれがあるものとして、厚生労働大臣が薬事審議会の意見を聴いて指定するものをいう。
- 医薬品医療機器等法に基づき、疾病の診断、治療、予防の用途および人の身体に対する危害の発生を伴うおそれがない用途(医療等の用途)以外の用途に供するために製造、輸入、販売、授与、所持、購入、譲り受けを行ってはならない。
▶103回一般理論(法規)143
指定薬物に関する記述のうち、正しいのはどれか。2つ選べ。
- 麻薬は、指定薬物に含まれる。
- 覚醒剤は、指定薬物に含まれる。
- 何人も広告を行ってはならない。
- 医薬品医療機器等法による「医療等の用途」以外の用途に使用してはならない。
- 厚生労働大臣は、指定薬物の疑いがある物品を発見した場合、その物品を貯蔵している者に対して、指定薬物であるかどうかの検査を受けるべきことを命ずることができる。
▶109回一般理論(法規)145
指定薬物に関する記述のうち、正しいのはどれか。2つ選べ。
- 麻薬及び向精神薬取締法に基づき、厚生労働大臣が指定する。
- 緊急を要する場合、薬事・食品衛生審議会の意見を聴かずに、厚生労働大臣が指定できる。
- ジアセチルモルヒネ(ヘロイン)は指定薬物に該当する。
- 指定には、1つ1つの物質を個別に指定(個別指定)と特定の構造を有する物質を一括した指定(包括指定)の2つがある。
- 「医療等の用途」以外の用途に供するための製造、販売、購入等は禁止されているが、所持の制限はない。
▶100回一般(法規)142
医薬品医療機器等法で規制される指定薬物に関する記述のうち、正しいのはどれか。1つ選べ。
- 指定薬物を含有する植物は、すべて指定薬物として規制される。
- 指定薬物の製造、販売等が認められる「医療等の用途」とは、疾病の診断、治療又は予防の用途及び犯罪鑑識の用途のみである。
- 指定薬物の広告に関する規制はない。
- 厚生労働大臣は、医薬品医療機器等法の規定に違反して販売された指定薬物を薬事監視員に回収させることができる。
- 医薬品医療機器等法の規定に違反して指定薬物を販売した者に対する罰則は、罰金のみである。
毒薬・劇薬
- 医薬品のうち毒性・劇性が強いものを厚生労働大臣が薬事・食品衛生審議会の意見を聴いて毒薬・劇薬として指定する。
- 毒薬は容器または被包に、黒地・白枠・白字で「毒」の文字を記載しなければならない。一方、劇薬は白地・赤枠・赤字で「劇」の文字を記載しなければならない。
▶105回必須(法規)72
毒薬は、直接の容器又は直接の被包に「【 ① 】地に【 ② 】枠、【 ② 】字をもって、品名及び「毒」の文字」を記載する。色の組合せとして正しいのはどれか。1つ選べ。
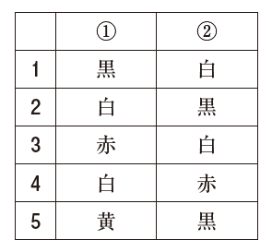
毒薬・劇薬の規定
- 業務上毒薬または劇薬を取り扱う者は、他の物と区別して貯蔵、陳列しなければならない。毒薬については、貯蔵、陳列する場所にかぎを施さなければならない。
- 毒薬または劇薬は、14歳未満の者その他安全な取扱いをすることについて不安があると認められる者には交付してはならない。
▶103回一般理論(法規)142
毒薬又は劇薬に関する記述のうち、正しいのはどれか。2つ選べ。
- 毒薬には、その直接の容器又は直接の被包に、白地に赤枠、赤字をもって、その品名及び「毒」の文字が記載されていなければならない。
- 薬局開設者は、封を開いて毒薬を販売することができる。
- 薬局開設者は、常時取引関係を有する薬剤師に対して劇薬を販売する場合、法で定められた事項が記載された文書を受け取る必要はない。
- 毒薬又は劇薬は、16歳未満の者には交付してはならない。
- 病院又は診療所において、劇薬を貯蔵する場所にはかぎを施さなければならない。
▶99回一般(法規)141
処方せん医薬品並びに毒薬及び劇薬に関する記述のうち、正しいのはどれか。2つ選べ。
- 体外診断用医薬品は、処方せん医薬品として指定される。
- 正当な理由があれば、処方せんを受けた者以外の者に対して、処方せん医薬品を販売または授与することができる。
- 薬局開設者は、処方せん医薬品の販売又は授与を記録した帳簿を、最終の記載の日から3年間保存しなければならない。
- 業務上劇薬を取り扱う者は、貯蔵する場所に「医薬品」及び「劇」の文字を表示しなければならない。
- 毒薬は、かぎをかけた場所に他の物と区別して貯蔵しなければならない。
医療品等の安全対策
6編2章:医薬品等の安全性と有効性の確保
医薬品リスク管理計画(RMP:Risk Management Plan)
- RMPは、医薬品の開発から市販後まで一貫したリスク管理をまとめた文書で、医薬品の安全性の確保を図るものである。
- 設定された安全性検討事項(重要な特定リスク、潜在的リスク、不足情報)に対して、医薬品安全性監視活動とリスク最小化活動の計画が策定され、その実施状況や報告内容に基づいて、ベネフィット・リスクバランスが評価される。
▶105回必須(法規)74
以下の略語のうち、医薬品の開発段階から安全対策を実施することで、製造販売後の医薬品の安全性の確保を図ることを目的とするのはどれか。1つ選べ。
- DPC
- EBM
- IRB
- RMP
- SDG
▶107回一般理論(法規)144
医薬品リスク管理計画に関する説明のうち、正しいのはどれか。2つ選べ。
- GCP省令に基づき、医薬品の製造販売後のリスクとベネフィットを評価する。
- 安全性検討事項として、重要なリスクを特定し、それに対して安全性監視計画とリスク最小化計画を策定・実施する。
- 安全性検討事項には、特定されたリスクに加え、潜在的なものや不足情報も含まれる。
- 安全性監視計画には、添付文書の作成や改訂が含まれる。
- リスク最小化計画には、副作用・感染症報告制度に基づく副作用評価が含まれる。
市販直後調査
▶107回必須(法規)73
GVP省令に基づき、新医薬品の適正使用のための情報提供と副作用情報の把握のために、市販後のある一定期間、製造販売業者が行う調査はどれか。1つ選べ。
- 一般使用成績調査
- 製造販売後臨床試験
- 市販直後調査
- 特定使用成績調査
- 使用成績比較調査
▶109回必須(法規)74
新有効成分含有医薬品等の市販直後調査の実施は、どの時点から6ケ月と規定されているか。1つ選べ。
- 承認申請した時
- 承認を受けた時
- 販売を開始した時
- 薬価収載された時
- 医薬品リスク管理計画を策定した時
添付文書
- 医薬品医療機器等法に基づき、医薬品等の適正な使用や安全性に関する情報を伝達するため、医薬品等に添付する添付文書等により、使用上の注意や用法・用量などの情報提供が行われている。
- 医薬品等の製造販売業者には添付文書等記載事項の届出・公表が義務づけられており、記載事項に必要な変更が生じた場合届け出る必要がある。
▶106回一般理論(法規)147
医薬品の添付文書等(医薬品に添付する文書又はその容器若しくは被包)に関する記述のうち、正しいのはどれか。2つ選べ。
- 製造販売業者は、添付文書等記載事項について、法令で定められた方法によって公表しなければならない。
- 添付文書等記載事項は、薬価改定にあわせて変更しなければならない。
- 添付文書等記載事項は、医薬品に関する最新の論文その他により得られた知見に基づき、記載されていなければならない。
- 製造販売業者は、厚生労働大臣が指定する医薬品の添付文書等記載事項の内容について、あらかじめ厚生労働大臣の許可を受けなければならない。
- 添付文書等に承認を受けていない効能又は効果を記載するためには、承認を受けていない旨を注記しなければならない。
▶104回必須(病態)67
要指導医薬品及び一般用医薬品の添付文書への記載項目に該当しないのはどれか。1つ選べ。
- 製品の特徴
- 使用上の注意
- 効能又は効果
- 臨床成績
- 用法及び用量
▶101回必須(病態)66
一般用医薬品の添付文書に記載する必要のない項目はどれか。1つ選べ。
- 改訂年月
- 添付文書の必読及び保管に関する事項
- 製品の特徴
- 薬効薬理
- 消費者相談窓口
医薬品インタビューフォーム
▶103回必須(病態)66
医薬品インタビューフォームに関する記述のうち、正しいのはどれか。1つ選べ。
- 医薬品医療機器等法で定められた公文書である。
- 医療用医薬品添付文書を補完する三次資料である。
- 記載事項は医療用医薬品添付文書と同一である。
- 独立行政法人医薬品医療機器総合機構(PMDA)が作成し、提供している。
- 厚生労働省が記載要領を策定している。
医薬品安全対策情報(DSU)
▶108回必須(病態)69
医療用医薬品の「使用上の注意」改訂を取りまとめた医薬品情報源はどれか。1つ選べ。
- 医薬品リスク管理計画(RMP)
- 重篤副作用疾患別対応マニュアル
- 緊急安全性情報
- 医薬品安全対策情報(DSU)
- 医療用医薬品製品情報概要
▶106回必須(病態)69
図中の【 ア 】に入る語句はどれか。1つ選べ。

- COCHRANE LIBRARY
- DRUG SAFETY UPDATE
- INTERVIEW FORM
- PHYSICIANSʼ DESK REFERENCE
- RISK MANAGEMENT PLAN
緊急安全性情報(イエローレター)
▶103回必須(実務)82
添付文書の「警告」や「禁忌」に追加する情報を迅速に伝達するために、厚生労働省の指示のもとに製造販売業者が作成する文書はどれか。1つ選べ。
- 医療用医薬品製品情報概要
- イエローレター
- 医薬品安全対策情報
- 医薬品・医療機器等安全性情報
- 医薬品インタビューフォーム
安全性速報(ブルーレター)
▶99回必須(病態)66
医薬品等の安全性に関する重要な情報であり、緊急安全性情報に準じ厚生労働省の指示で製造販売業者が作成し、指示後1ヶ月以内に医療関係者へ伝達するものはどれか。1つ選べ。
- PMDA医療安全情報
- 安全性速報
- 医薬品安全対策情報
- 医薬品・医療機器等安全性情報
- 医療用医薬品製品情報概要
医薬品・医療機器等安全性情報
▶107回必須(病態)69
厚生労働省が発行する資料はどれか。1つ選べ。
- 医療用医薬品添付文書
- 医薬品インタビューフォーム
- 医薬品リスク管理計画
- 医薬品・医療機器等安全性情報
- くすりのしおり
医薬品等に係る被害救済制度
- 医薬品を適正に使用して発生した副作用被害で、賠償責任を有する者が不明である健康被害に対し、医薬品医療機器総合機構(PMDA)が救済給付を行っている。
- 救済給付の種類として、医療費、医療手当、障害年金、障害児養育年金、遺族年金、遺族一時金、葬祭料がある。
▶104回一般理論(法規)146
独立行政法人医薬品医療機器総合機構法において規定されている副作用被害救済給付の対象となるのはどれか。2つ選べ。なお、いずれの場合も入院を要する程度の健康被害とする。
- 副作用の原因となった許可医薬品について、賠償責任者が不明である場合
- 救命のためやむをえず通常の使用量を超えて許可医薬品を使用したことにより生じた副作用で、その発生があらかじめ認識されていた場合
- 任意に予防接種を受けたことにより副作用が生じた場合
- 抗悪性腫瘍剤のアクチノマイシンDを使用したことにより副作用が生じた場合
▶102回必須(法規)76
医薬品副作用被害救済制度における副作用救済給付の対象として、誤っているのはどれか。1つ選べ。
- 医療費
- 医療手当
- 障害年金
- 休業保障
- 葬祭料
再評価制度
▶101回必須(法規)78
すでに承認されている医薬品について、その時点での知見に基づいて承認の可否を見直す制度はどれか。1つ選べ。
- 使用成績調査
- 医薬品リスク管理
- 薬価改定
- 再評価
- 製造販売後臨床試験
再審査制度
- 再審査制度は、新医薬品等の承認後に使用成績の調査などの市販後調査を行わせ、一定期間の後にその医薬品の有効性と安全性を確認するものである。
- 対象となる新医薬品等とは、すでに製造販売の承認を与えられている医薬品と、有効成分、分量、用法、用量、効能、効果などが明らかに異なる医薬品である。
▶106回一般理論(法規)144・98回必須(法規)78類問
医薬品の再審査制度に関する記述のうち、適切なのはどれか。1つ選べ。
- 再審査制度は、特許期間の終了前に医薬品の有効性及び安全性を再確認する制度である。
- 再審査のための調査や試験に必要な期間を再審査期間として、製造販売業者が厚生労働大臣に届出を行う。
- 再審査申請書には、医薬品の使用成績調査に関する資料の添付が必要である。
- 再審査期間中の副作用報告は、製造販売業者のみに対し義務づけられている。
- 後発医薬品は、再審査の対象となっている。
医薬品等の広告
▶104回一般理論(法規)142
医薬品等の広告に関する記述のうち、正しいのはどれか。1つ選べ。
- 医薬関係者向けの専門誌には、承認される前の医薬品の広告を掲載できる。
- 医薬関係者向けの専門誌には、医薬品医療機器等法に基づいて指定されたがんの治療薬の広告を掲載できる。
- 放送事業者や出版社は、我が国で未承認の医療機器であっても、海外で承認されていれば性能・効果を広告できる。
- 放送事業者や出版社は、医薬品の効能・効果を誇大に広告できる。
- 放送事業者や出版社は、医師が医薬品の効能・効果を保証する記事を広告できる。
覚醒剤取締法
6編3章:特殊な医薬品、毒物・劇物
概要
- 覚醒剤取締法は、覚醒剤およびその原料の輸入、輸出、所持、製造、譲渡、譲受、使用に関して必要な取締りを行うことを目的とする。
- 覚醒剤として、フェルアミノプロパン、フェニルメチルアミノプロパン及び各その塩類のほか、政令で指定された覚醒作用を有するものが掲げられる。
▶105回必須(法規)77
覚醒剤取締法で規制されるのはどれか。1つ選べ。
- 大麻
- モルヒネ
- 亜硝酸イソブチル
- フェニルアミノプロパン
- ペンタゾシン
医薬品である覚醒剤原料の取扱い
- 医薬品である覚醒剤原料は、鍵をかけた堅固な場所で保管しなければならない。
- 薬局開設者は、処方箋に基づき調剤した医薬品である覚醒剤原料を患者に譲り渡すことができる。
▶107回一般理論(法規)146
医薬品である覚醒剤原料について、薬局における法令に基づく取扱いとして、正しいのはどれか。2つ選べ。
- かぎをかけて薬品庫に保管する。
- 麻薬と一緒に保管できる。
- 薬局で調剤するためには、覚醒剤施用機関としての指定を受ける必要がある。
- 処方箋に基づき調剤し、患者に譲渡することができる。
- 使用期限が切れた調剤前のものを廃棄した場合、30日以内に都道府県知事に届け出る。
大麻取締法
6編3章:特殊な医薬品、毒物・劇物
大麻
- 「大麻」とは、大麻草(カンナビス・サティバ・エル)とその製品をいう。
- ただし、大麻草の成熟した茎とその製品(樹脂を除く)、大麻草の種子とその製品を除く。
▶109回必須(法規)77
大麻取締法で規定される「大麻」に該当しない大麻草(カンナビス・サティバ・エル)の部位はどれか。1つ選べ。
- 花穂
- 未熟な茎
- 葉
- 種子
- 根
麻薬及び向精神薬取締法
6編3章:特殊な医薬品、毒物・劇物
麻薬取扱者
麻薬輸入業者、麻薬輸出業者、麻薬製造業者、麻薬製剤業者、家庭麻薬製造業者、麻薬元卸売業者
●都道府県知事の免許を受ける者
麻薬卸売業者、麻薬小売業者、麻薬施用者、麻薬管理者、麻薬研究者
▶104回必須(法規)75
都道府県知事の免許を受けることが必要なのはどれか。1つ選べ。
- 麻薬製剤業者
- 麻薬輸出業者
- 麻薬輸入業者
- 麻薬小売業者
- 麻薬製造業者
麻薬処方箋
- 麻薬施用者は、麻薬を記載した処方箋(麻薬処方箋)を交付する。そこには、患者の氏名、麻薬の品名、分量、用法用量、自己の氏名、免許証の番号等を記載しなければならない。
- 麻薬小売業者は、都道府県知事の免許を受けて、麻薬処方箋により調剤された麻薬を譲り渡すことを業とする。
▶109回必須(実務)90・98回必須(実務)86類問
麻薬及び向精神薬取締法に基づき、入院患者の麻薬処方箋に記載しなければならない必須事項はどれか。1つ選べ。
- 患者の住所
- 処方箋の使用期間
- 麻薬施用者の免許証の番号
- 麻薬業務所の名称
- 麻薬業務所の所在地
▶106回必須(法規)76
麻薬処方箋により調剤された麻薬を譲り渡すことを業とする者はどれか。1つ選べ。
- 麻薬製造業者
- 麻薬卸売業者
- 麻薬小売業者
- 麻薬施用者
- 麻薬管理者
麻薬の輸出
- 麻薬輸出業者でなければ麻薬を輸出してはならない。
- ただし、本邦から出国する者が、厚生労働大臣の許可を受けて、自己の疾病の治療の目的で携帯して輸出する場合を除く。
- なお、向精神薬も同様に携帯して出国(輸出)できるが、厚生労働大臣の許可は要しない。
▶106回必須(法規)77
患者が自らの治療のために、2週間程度の海外旅行に携帯する場合、地方厚生(支)局長の許可が必要となるのはどれか。1つ選べ。なお、地方厚生(支)局長は、厚生労働大臣から権限が委任されているものとする。
- 麻薬
- 向精神薬
- あへん
- 覚醒剤
- 大麻
証紙による封かん
- 麻薬輸入業者、麻薬製造業者、麻薬製剤業者は、小分けした麻薬を譲り渡す場合、麻薬を収めた容器または容器の直接の被包に、政府発行の証紙で封を施さなければならない。
- 麻薬小売業者を除く麻薬営業者は、封が施されているままでなければ麻薬を譲り渡してはならない。
- 麻薬施用者または麻薬小売業者は、封が施されているまま、麻薬を交付、譲り渡してはならない。
▶107回必須(法規)76
次のうち、麻薬及び向精神薬取締法に基づく「証紙による封かん」の封が施されていない麻薬を譲り渡すことができる業者はどれか。1つ選べ。
- 麻薬輸入業者
- 麻薬製造業者
- 麻薬元卸売業者
- 麻薬卸業者
- 麻薬小売業者
向精神薬取扱者
向精神薬輸入業者、向精神薬輸出業者、向精神薬製造製剤業者、向精神薬使用業者
●都道府県知事の免許を受ける者
向精神薬卸売業者、向精神薬小売業者
薬局開設の許可を受けた者は、向精神薬卸売業者および向精神薬小売業者の免許を受けた者とみなす。
▶105回必須(法規)71
薬局開設者が、都道府県知事に別段の申出をしない限り、免許を受けたとみなされるのはどれか。1つ選べ。
- 向精神薬輸入業者
- 向精神薬輸出業者
- 向精神薬製造製剤業者
- 向精神薬使用業者
- 向精神薬小売業者
事故の届出
▶102回必須(法規)75
薬局で向精神薬を取扱う場合、法令に基づいて届出が必要とされているのはどれか。1つ選べ。なお、薬局は、向精神薬営業者に関して別段の申し出はしていないものとする。
- 処方箋に基づく譲渡
- 他の薬局への譲渡
- 向精神薬卸売業者からの譲受
- 廃棄
- 一定量以上の滅失、盗取等の事故
向精神薬の分類
- 向精神薬は、その乱用の危険性と治療上の有用性により、第1種向精神薬、第2種向精神薬、第3種向精神薬の3種類に分類されている。
- 向精神薬輸入業者または向精神薬輸出業者が、第1種向精神薬を輸入または輸出しようとする場合、その都度厚生労働大臣の許可を受けなければならない。
- 向精神薬営業者は第1種向精神薬、第2種向精神薬を譲り渡し、譲り受け、または廃棄した場合、その品目、数量、年月日等の事項を記録しなければならない。
▶105回必須(実務)86
薬局間で譲渡を行う際、譲受・譲渡の記録が法律上必要なのはどれか。1つ選べ。
- 化粧品
- 医薬部外品
- 第二類医薬品
- 指定第二類医薬品
- 第二種向精神薬
▶103回一般理論(法規)146
向精神薬に関する記述のうち、正しいのはどれか。2つ選べ。
- 向精神薬は、第一種及び第二種向精神薬の2種類に分類される。
- 向精神薬取扱者が、向精神薬を廃棄する場合には、届出は不要である。
- 向精神薬卸売業者は、免許を受けた業務所が所在する都道府県外の向精神薬小売業者に向精神薬を譲り渡すことができない。
- 向精神薬を調剤する際には、都道府県知事の免許を受けた医師の処方箋であることの確認が必要である。
- 薬局開設者は、辞退を申し出ない限り、向精神薬卸売販売業及び向精神薬小売業の免許を受けた者とみなされる。
▶99回一般(法規)145
麻薬及び向精神薬の取扱いについて、正しいのはどれか。2つ選べ。なお、地方厚生(支)局長は、厚生労働大臣から権限が委任されているものとする。
- 向精神薬を用いて動物実験等の研究を行う施設の設置者の登録は、地方厚生(支)局長又は都道府県知事が行う。
- 麻薬研究者が研究用の麻薬を製造する場合は、その都度、都道府県知事の許可が必要である。
- 海外旅行をする際、向精神薬を携帯するには、地方厚生(支)局長の許可が必要である。
- 家庭麻薬製造業者は、特段の許可を受けることなくコデイン、ジヒドロコデイン及びその塩類を麻薬製剤業者に譲り渡すことができる。
- 向精神薬輸出業者が第一種向精神薬を輸出する際には、その都度、地方厚生(支)局長の許可が必要である。
毒物及び劇物取締法
6編3章:特殊な医薬品、毒物・劇物
毒物・劇物の表示
- 「医薬用外」の文字
- 毒物については赤地に白色をもって「毒物」の文字
- 劇物については白地に赤色をもって「劇物」の文字
▶107回必須(法規)75
毒物劇物営業者が行う毒物の容器及び被包への表示方法として、正しいのはどれか。1つ選べ。
- 「医薬用外」の文字及び白地に黒色をもって「毒物」の文字
- 「医薬用外」の文字及び黒地に白色をもって「毒物」の文字
- 「医薬用外」の文字及び赤地に白色をもって「毒物」の文字
- 「医薬用外」の文字及び白地に赤色をもって「毒」の文字
- 「医薬用外」の文字及び白地に黒色をもって「毒」の文字
営業の登録・毒物劇物取扱責任者
- 毒物または劇物の製造業、輸入業、販売業の登録は、製造所、営業所、店舗ごとに都道府県知事が行う。登録事項として、製造業または輸入業では毒物または劇物の品目を登録しなければならない。
- 製造業または輸入業の登録は5年ごとに、販売業の登録は6年ごとに更新を受けなければ、その効力を失う。
○毒物劇物取扱責任者
- 毒物劇物営業者は、毒物又は劇物を直接取り扱う製造所等ごとに専任の毒物劇物取扱責任者を置き、保健衛生上の危害の防止に当たらせなければならない。
- 毒物劇物取扱責任者は、①薬剤師、②厚生労働省令で定める学校で、応用化学に関する学課を修了した者、③都道府県知事が行う毒物劇物取扱者試験に合格した者でなければなることができない。
▶106回一般理論(法規)149
毒物及び劇物取締法に関する記述のうち、正しいのはどれか。2つ選べ。
- 毒物劇物営業者は、毒物又は劇物を直接に取り扱う製造所、営業所又は店舗ごとに、原則として、専任の毒物劇物取扱責任者を置かなければならない。
- 毒物劇物取扱責任者は、薬剤師でなければならない。
- 毒物又は劇物の製造業の登録及び販売業の登録は、毎年、更新を受けなければその効力を失う。
- 毒物又は劇物の製造業の登録は、製造しようとする品目を登録しなければならない。
- 毒物又は劇物の製造業の登録を行えば、登録品目と同じ毒物又は劇物の輸入を行うこともできる。
特定毒物研究者・特定毒物使用者
特定毒物研究者とは、学術研究のために特定毒物を製造、輸入、使用する者として都道府県知事から許可を受けた者で、特定毒物を学術研究以外の用途に供してはならない。
●特定毒物使用者
特定毒物使用者とは、特定毒物を使用することができる者として品目ごとに政令で指定する者で、特定毒物を品目ごとに政令で定める用途以外の用途に供してはならない。
▶103回一般理論(法規)147
特定毒物の取扱いに関する記述のうち、正しいのはどれか。2つ選べ。
- 毒物劇物営業者は、特定毒物を所持できない。
- 特定毒物研究者になるには、都道府県知事(又は政令指定都市の市長)の許可が必要である。
- 特定毒物使用者は、特定毒物の用途に制限を受けない。
- 特定毒物研究者は、特定毒物を貯蔵する場所に「特定毒物」の文字を表示しなければならない。
- 毒物劇物輸入業者は、特定毒物を輸入できる。
▶109回一般理論(法規)146
毒物及び劇物取締法に関する記述のうち、正しいのはどれか。2つ選べ。
- 興奮、幻覚、麻酔作用を有する毒物又は劇物を交付する場合、その交付を受ける者の氏名及び住所を確認しなければならない。
- 引火性、発火性又は爆発性を有し、業務その他正当な目的以外での所持が認められないものとして、トルエンが指定されている。
- 特定毒物使用者は、特定毒物を品目ごとに政令で定める用途以外の用途に供してはならない。
- 毒物及び劇物の容器・被包には「医薬用外」の文字とともに、毒物については黒地に白色で「毒物」の文字、劇物については白地に赤色で「劇物」の文字を表示しなければならない。
- 毒物劇物営業者は、毒物又は劇物を直接に取り扱う製造所、営業所又は店舗ごとに原則として、専任の毒物劇物取扱責任者を置かなければならない。
その他の各種規定
●届出
毒物劇物営業者は、氏名や住所、法人名や事務所の所在地等を変更した場合、30日以内に所在地の都道府県知事にその旨を届け出なければならない。
●事故の際の措置
毒物劇物営業者・特定毒物研究者は、毒物または劇物が盗難にあい、または紛失した場合、直ちに警察署に届け出なければならない。
●譲渡手続
毒物劇物営業者は、毒物または劇物を他の毒物劇物営業者に販売、授与したときは、その都度、必要事項を書面に記載しておかなければならず、販売または授与の日から5年間保存しなければならない。
▶101回一般理論(法規)145
毒物及び劇物取締法に関する記述のうち、正しいのはどれか。2つ選べ。
- 特定毒物研究者は、特定毒物を学術研究以外の用途で使用することができる。
- 毒物劇物営業者は、毒物又は劇物を直接に取り扱う製造所、営業所又は店舗ごとに、原則として、専任の毒物劇物取扱責任者を置かなければならない。
- 毒物劇物営業者は、毒物又は劇物の譲渡に係る書面を、販売又は授与の日から10年間保管しなければならない。
- 毒物劇物営業者は、その取扱いに係る毒物又は劇物が盗難にあい、又は紛失したときは、直ちに、その旨を警察署に届け出なければならない。
- 毒物劇物営業者は、その製造所、営業所又は店舗の名称を変更したときは、新たに登録を受けなければならない。
安全な血液製剤の安定供給の確保等に関する法律〈血液法〉
6編3章:特殊な医薬品、毒物・劇物
理念
- 血液製剤の安全性の向上
- 血液製剤の国内自給の確保と安定供給
- 血液製剤の適正使用の推進
- 施策の策定・実施に当たり公正の確保と透明性の向上
▶106回必須(法規)75
国内自給確保の基本理念が法律で規定されているのはどれか。1つ選べ。
- ワクチン製剤
- 血液製剤
- 麻薬製剤
- 漢方製剤
- 抗生物質製剤
▶99回一般(法規)144
安全な血液製剤の安定供給の確保等に関する法律に規定されている基本理念に掲げられていないのはどれか。1つ選べ。
- 血液製剤は、その安全性の向上に常に配慮して、製造、供給又は使用されなければならない。
- 血液製剤は、貴重なものであること等から、適正に使用されなければならない。
- 血液製剤は、できるだけ低廉な価格で供給されるようにしなければならない。
- 血液製剤は、国内自給が確保されることを基本とするとともに、安定的に供給されるようにしなければならない。
- 血液製剤に関する施策の策定及び実施に当たっては、公正の確保及び透明性の向上が図られるよう努めなければならない。
採血に係る規定
- 血液製剤の原料とするために、業として人体から採血しようとする者は、厚生労働大臣の許可を受けなければならない。ただし、病院または診療所で診療のために用いられる血液製剤のみの原料とする目的での採血はこの限りでない。
- 何人も有料で人体から採血し、または人の血液の提供のあっせんをしてはならない。
- 業として人体から採血することは、医療及び歯科医療以外の目的で行われる場合であっても、医師法に規定する医業に該当するものとする。
▶102回一般理論(法規)145
安全な血液製剤の安定供給の確保等に関する法律に関する記述のうち、正しいのはどれか。2つ選べ。
- 血液製剤は、医薬品医療機器等法上の医薬品から除外されている。
- 血液製剤を製造販売する場合は、この法律の規定による許可を受けなければならない。
- 病院又は診療所以外の場所において、血液製剤の原料とする目的で、業として人体から採血するには、厚生労働大臣の許可が必要である。
- 業として採血することは、医業にあたる。
- 血液製剤の原料とする目的で採血するときは、その対価を支払うことができる。










